האטום הוא החלק הקטן ביותר של חומר היסוד, אשר עדיין שומר על תכונות החומר. באטום עצמו יש חלקיקים קטנים יותר, חלקיקים יסודיים, אך אם אינם שומרים על תכונות החומר.
האטומים הם קטנים ביותר, גודלם הוא בין 60 פיקו-מטר (פיקו-מטר הוא מיליונית של מיליונית המטר) לאטום הליום ועד 500 פיקו-מטר לאטום צסיום. לא ניתן לראות אטום יחיד בעין בלתי מזוינת ובקושי ניתן להבחין באטום יחיד שלם במיקרוסקופים אלקטרוניים משוכללים. בשום מקרה לא ניתן לראות את החלקיקים מהם בנוי האטום. לכן, מה שיש למדע הוא תיאוריה, או דגם (מודל) של האטום. אין צורך להיבהל מכך שמדובר בדגם בלבד ואין מה לבטל את התיאוריה – הישגי המדע בפיסיקה גרעינית מעידים על כך שהתיאוריה והדגם הם מקורבים מספיק ומדויקים מספיק – מספיק כדי לייצר פצצות אטום ופצצות מימן, בין היתר.
האטום הוא מעין כדור זעיר אשר במרכזו גרעין ואת הגרעין מקיפים אלקטרונים הנעים סביב הגרעין במהירות עצומה, קרובה למהירות האור. מהירות תנועת האלקטרונים מושפעת מהטמפרטורה ביחס ישר, ככל שהטמפרטורה גבוהה יותר, מהירות האלקטרונים גבוהה יותר. בגרעין יש חלקיקים הנקראים נוקלאונים והם נחלקים לשני סוגים, פרוטונים ונייטרונים (או ניוטרונים). כל פרוטון וכל נייטרון מורכב משלושה חלקיקי יסוד הנקראים קוורקים – אבל זה מעבר לקורס הנוכחי.
לכל אחד מחלקיקי היסוד (פרוטון, נייטרון ואלקטרון) יש מסה ("משקל"). לפרוטון ולאלקטרון יש גם מטען חשמלי, בעוד לנייטרון אין מטען חשמלי.
המסה של הפרוטון והנייטרון די קרובה, אם כי המסה של הנייטרון מעט גדולה יותר מהמסה של הפרוטון. לפרוטון מסה גדולה יותר בערך פי 2,000 מהמסה של האלקטרון. כך, רוב רובה של המסה של האטום מצויה בגרעין האטום, לגרעין האטום בערך 99.9% מהמסה של כלל האטום.
לנייטרון אין מטען חשמלי, לפרוטון יש מטען חשמלי חיובי ולאלקטרון יש מטען חשמלי שלילי. המטען החשמלי של פרוטון זהה בגודלו אך הפוך בסימנו למטען החשמלי של האלקטרון.
בין מטענים חשמליים זהים יש דחייה ובין מטענים חשמליים הופכיים (מנוגדים) יש משיכה.
באטומים המצויים בטבע, במצבם הטבעי הבסיסי, מספר הפרוטונים זהה למספר האלקטרונים, אך מספר הנייטרונים אינו קבוע.
הפרוטונים והנייטרונים שבגרעין האטום מוחזקים יחד על ידי הכוח החזק, שהוא חזק הרבה יותר מהדחייה החשמלית שבין הפרוטונים.
בין האלקטרונים לבין גרעין האטום פועלים שני כוחות:
הכוח האחד הוא כוח המשיכה שבין האלקטרון לפרוטון, הגורם לאלקטרון לנטייה להיצמד לגרעין; הכוח השני הוא הכוח הצנטריפוגלי, הגורם לאלקטרון לנטייה "להיזרק החוצה" מהמרכז, שהוא הגרעין. בפועל, באטום מתקיים איזון בין שני כוחות אלה, כך שהאלקטרונים נעים במסלוליהם, מבלי להתחבר לגרעין האטום ומבלי לברוח ממנו. מדובר כאן באיזון עדין, עדיין קורה לעתים שאלקטרונים עוזבים את האטום. נרחיב על כך בהמשך, יש לזה חשיבות בהבנת זרם חשמלי ותופעות נוספות באלקטרוניקה.
התיאוריה המוקדמת של מבנה האטום
על פי התיאוריה המוקדמת של מבנה האטום (מראשית המאה העשרים), האלקטרונים נעים סביב הגרעין במסלולים אליפטיים, בדומה לכוכבי לכת סביב השמש.
שני האיורים הבאים מתארים דגם מקורב של מבנה האטום עלפי התיאוריה המוקדמת:
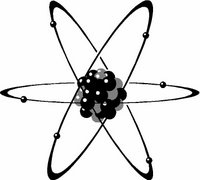
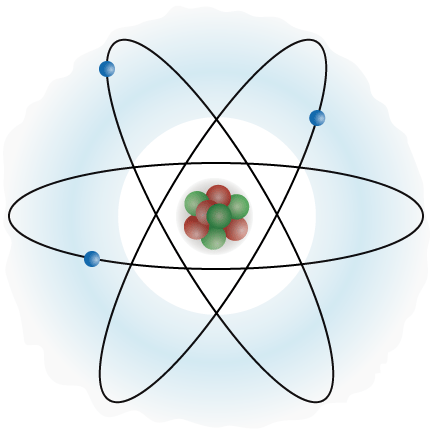
למעשה האיורים האלה לא משורטטים בקנה מידה נכון, משום שקוטר גרעין האטום הוא זעיר ביחס לקוטר האטום כולו, או ביחס למסלולי תנועת האלקטרונים. אפשר לדמות את גודל כלל האטום למגרש כדורסל, כאשר גודל גרעין האטום דומה לגודל כדור הכדורסל.
דימוי אחר של האטום הוא למערכת השמש. גרעין האטום הוא כמו השמש שבמרכז המערכת והאלקטרונים הם כמו כוכבי הלכת הנעים במסלולים אליפטיים סביב השמש. כמו באטום, גם במערכת השמש, קוטר השמש הוא קטן מאד ביחס לקוטר מסלול כוכב הלכת המרוחק ביותר מהשמש. במערכת השמש, כמו באטום, הכוח הפועל על האלקטרונים ועל כוכבי הלכת בכיוון החוצה מהמרכז הוא הכוח הצנטריפוגלי. במערכת השמש הכוח הפועל על כוכבי הלכת בכיוון המרכז הוא כוח הכבידה, בעוד באטום הכוח הפועל על האלקטרונים בכיוון המרכז הוא כוח המשיכה החשמלי בין האלקטרונים נושאי המטען החשמלי השלילי לבין הפרוטונים נושאי המטען החשמלי החיובי.
כאמור, הדגם שאיורים שלו הובאו למעלה הוא דגם מקורב. בנוסף, האיורים מראים מעין הקפאת מצב. אמנם האלקטרונים נעים במסלולים סביב הגרעין, אולם לא ניתן לדעת את המסלול המדויק של כל אלקטרון, או לא ניתן להגדיר מסלול מסוים, קבוע, עבור כל אלקטרון.
כאמור, האלקטרונים נעים סביב הגרעין במהירות גבוהה מאד, קרובה למהירות האור. אם היינו יכולים להביט באטום, בשל מהירותם הגבוהה של האלקטרונים, לא היינו יכולים לראות אותם. מה שהיינו רואים זה מעין ענן אלקטרונים.
האיור הבא הוא הדמיה של ענן אלקטרונים באטום הליום. הכתם האפור הוא ענן האלקטרונים והנקודה הסגולה במרכז הוא גרעין האטום, המאויר בהגדלה בצד ימין למעלה.
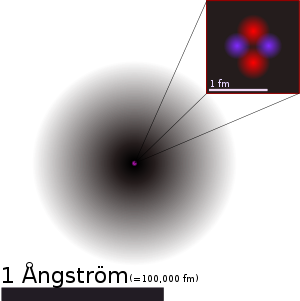
לבד מיוצא מהכלל אחד, לכל האטומים של חומרי היסוד המצויים בטבע, בגרעין האטום יש גם פרוטון, או פרוטונים וגם נייטרון, או נייטרונים. כאמור, במצבו הטבעי הבסיסי של האטום, מספר האלקטרונים זהה למספר הפרוטונים. לאלקטרון ולפרוטון מטען חשמלי זהה בעוצמתו, אך הפוך בכיוונו. כך, לאטום ככללו אין מטען חשמלי. במקרים בהם יש חריגה מהמצב הטבעי הבסיסי של האטום נדון בשיעורים הבאים.
חומרי היסוד, או היסודות, מסודרים לפי טבלה מחזורית הנקראת על שם מפתחה, טבלת מנדלייב. טבלת מנדלייב מסודרת לפי המספר האטומי.
המספר האטומי הוא מספר הפרוטונים בגרעין האטום. למימן יש פרוטון אחד ולכן מספרו האטומי הוא 1 . להליום יש שני פרוטונים ומספרו האטומי הוא 2 . לחמצן 8 פרוטונים ומספרו האטומי הוא 8 – וכך הלאה.
מספר המסה הוא מספר הפרוטונים והנייטרונים בגרעין האטום. לאטום הליום יש שני פרוטונים ושני נייטרונים, כך, מספר המסה שלו הוא 4 . כך, מספרו האטומי של הליום הוא 2 ומספר המסה שלו הוא 4 . מאחר ולאלקטרונים מסה מזערית וזניחה ביחס לפרוטונים ולנייטרונים, מחשבים את המסה של האטום על פי מספר המסה שלו.
לפעמים מספר הנייטרונים בגרעין זהה למספר הפרוטונים, אבל לא תמיד. יש יסודות, בעיקר אלה בעלי מספרי המסה הגבוהים, בהם בגרעין האטום יש יותר נייטרונים מאשר פרוטונים.
התיאוריה המודרנית של מבנה האטום
על פי תורת הקוונטים, עבור כל אלקטרון מוגדר אורביטל, שהוא פונקצית-גל, או נפח מחושב, אשר בו, בהסתברות, האלקטרון יימצא במשך 90% מהזמן, בערך. אורביטל הוא מעין ענן, או מעטפת תלת-ממדית, אשר צורתה משתנה בהתאם למיקומה.
האורביטל הראשון (הקרוב ביותר לגרעין) הוא מסוג S וצורתו כדורית.
האורביטל השני הוא מסוג P וצורתו היא דמוית שעון חול.
שאר האורביטלים מסובכים יותר לתיאור.
אין מידע בדוק באשר לאופן תנועתם של האלקטרונים בענן, או באורביטלים שלהם, האם תנועתם רציפה, או שהיא נעשית בקפיצות, או בכל דרך אחרת. אין לנו מושג היכן נמצא כל אלקטרון באורביטל שלו בכל רגע נתון וכיצד הוא עובר ממקום למקום באותו ענן, או אורביטל.
הרחבה בנושא זה היא מעבר לגבולות הקורס הנוכחי.
הרחבות נוספות ניתן לראות בקישורים הבאים:
אטום – ויקיפידיה
מבנה האטום - סיכומונה
מבנה האטום – ויקיספר
מבנה האטום - גוגל
אטום – ויקיפידיה באנגלית.


